Il “DNA spazzatura” è in grado di attivare la risposta immunitaria dei linfociti T, le sentinelle della lotta ai tumori
— di Lino Grossano
La ricerca, coordinata dall’Università degli Studi di Milano con la partecipazione del Policlinico di Milano, ha identificato per la prima volta un nuovo meccanismo che coinvolge molecole di RNA derivanti da “elementi ripetuti” del DNA: fino a pochi anni fa considerate “DNA spazzatura”, sono invece fondamentali per la corretta funzione dei linfociti T, cellule in prima linea nella lotta contro il cancro. La pubblicazione su Nature Genetics.
Le molecole di RNA non codificanti derivanti da DNA ripetuto, fino a pochi anni fa considerate poco importanti, sono invece fondamentali per l’attivazione e la funzionalità delle cellule immunitarie, in particolare dei linfociti T, e possono diventare un target farmacologico in strategie innovative di immunoterapia.
Lo studio, pubblicato su Nature Genetics, è stato coordinato da Beatrice Bodega, docente di Biologia molecolare, e Sergio Abrignani, docente di Patologia Generale, entrambi dell’Università degli Studi di Milano e dell’Istituto Nazionale di Genetica Molecolare "Romeo ed Enrica Invernizzi", ed è stato realizzato in collaborazione con l’IRCCS Istituto Clinico Humanitas e l’Humanitas University di Milano, il CheckmAb spin-off della Statale di Milano, il Grande Ospedale Metropolitano Niguarda di Milano, il Policlinico di Milano, l’ospedale San Giuseppe MultiMedica IRCCS di Milano.
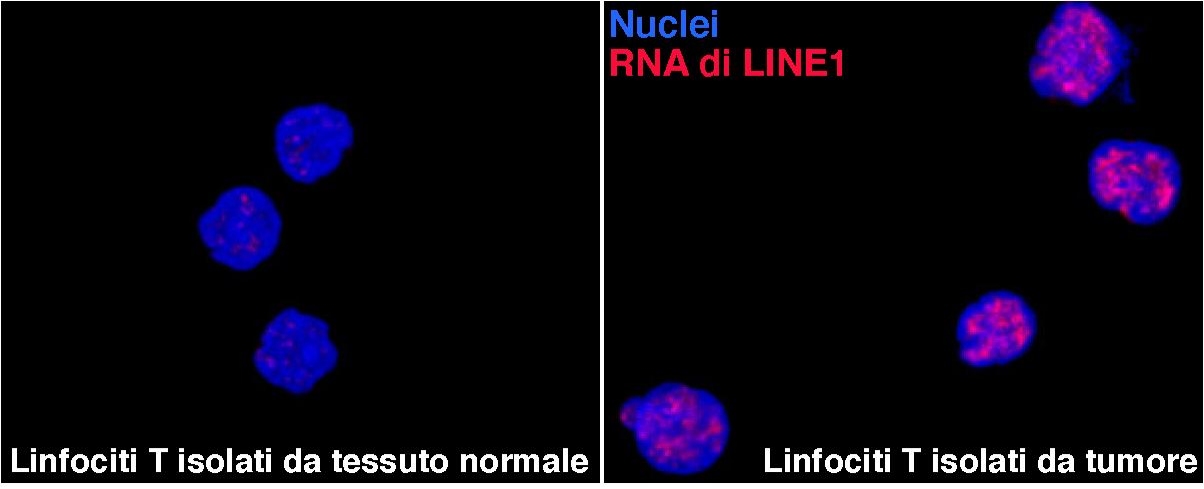
La ricerca ha dimostrato che delle molecole di RNA non codificanti, fino a poco tempo fa considerate senza valore, sono fondamentali per l’attivazione e la funzionalità delle cellule immunitarie, in particolare dei linfociti T CD4+. Questi RNA derivano da sequenze altamente ripetute nel nostro DNA (le sequenze LINE1) che hanno colonizzato il genoma umano, contribuendo alla sua evoluzione.
In particolare lo studio evidenzia che gli RNA di LINE1 si accumulano nei linfociti T CD4+ di tipo “Naive” (cellule considerate immature) e, quando queste cellule si attivano, le molecole di RNA di LINE1 diminuiscono drasticamente. Questo dipende da una diversa modulazione di queste molecole nella cellula immatura e nella cellula differenziata, che avviene tramite un meccanismo chiamato splicing delle molecole di RNA. Lo studio è stato condotto su cellule derivanti da donatori sani e su tessuti tumorali isolati da pazienti neoplastici.
È noto che i linfociti presenti nei tumori non sono più in grado di attivarsi ad eliminare le cellule tumorali. Sorprendentemente, invece, i linfociti CD4+ infiltranti i tumori riaccumulano gli RNA di LINE1 e i ricercatori hanno inoltre dimostrato in laboratorio che silenziando questi RNA, i linfociti T intratumorali riacquisiscono la capacità di eliminare le cellule neoplastiche.
“Riteniamo di aver identificato un potenziale nuovo bersaglio terapeutico da combinare alle immunoterapie odierne con anticorpi contro “Checkpoint inhibitor”, spiegano Beatrice Bodega e Sergio Abrignani. “L’obiettivo futuro è la creazione di una startup che possa sviluppare nuove terapie che, spegnendo l’RNA di LINE1 nei Linfociti T intratumorali, possa risvegliare il sistema immunitario silente nel microambiente intratumorale, in modo che i linfociti T possano nuovamente riconoscere e distruggere le cellule neoplastiche”.
"Si tratta di un lavoro di grande importanza - commenta Daniele Prati, direttore del Centro Trasfusionale del Policlinico di Milano e co-autore dello studio - perché chiarisce alcuni meccanismi della malattia che saranno fondamentali per andare a ricercare nuove strategie terapeutiche contro i tumori. In questo tipo di studi è sempre più fondamentale avere dati che mettano a confronto le caratteristiche dei pazienti con quelle dei soggetti sani: purtroppo non è sempre facile riuscire a fare questa distinzione tra i diversi stati di salute. Per questo è stato importante poter mettere a disposizione il lavoro della nostra Biobanca, coordinata con Luca Valenti: senza questa mole di dati, ma soprattutto senza la proficua collaborazione tra istituti, risultati del genere non sarebbero possibili".
La ricerca è stata condotta grazie ai finanziamenti di Fondazione Regionale per la Ricerca Biomedica (FRRB), Fondazione Cariplo e AIRC - Associazione Italiana per la Ricerca sul cancro.







 News e consigli dagli esperti
News e consigli dagli esperti